
Innholdsfortegnelse:
- Forfatter Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:06.
Frysepunktdepresjon er en kolligativ egenskap observert i løsninger som er et resultat av introduksjon av oppløste molekyler til et løsemiddel. Frysepunktene til løsningene er alle lavere enn det rene løsningsmidlet og er direkte proporsjonale med molaliteten til det løste stoffet.
Tilsvarende, hvordan beregner du Molalitet fra frysepunktsdepresjon?
Strategi:
- Trinn 1: Beregn frysepunktet for benzen. Tf = (Frysepunkt for rent løsningsmiddel) - (Frysepunkt for løsning)
- Trinn 2: Beregn molkonsentrasjonen til løsningen. molalitet = mol oppløst stoff / kg løsemiddel.
- Trinn 3: Beregn Kf av løsningen. Tf = (Kf) (m)
På samme måte, hvorfor brukes Molality i frysepunktet? Wendy K. Kolligative egenskaper er fysiske egenskaper til løsninger, som koking punkt høyde og Frysepunktet depresjon. Det er derfor vi bruker molalitet (mol oppløst stoff per kg løsemiddel) siden kg løsemiddel ikke endres med temperatur.
Spørsmålet er også, hva mener du med depresjon av frysepunktet?
Frysepunktdepresjon oppstår når Frysepunktet av en væske senkes eller deprimert ved å tilsette en annen forbindelse til den. Løsningen har en lavere Frysepunktet enn det rene løsningsmidlet.
Hvordan påvirker molalitet kokepunktet?
Jo høyere konsentrasjon ( molalitet ), jo høyere kokepunkt . Du kan tenke på dette effekt som oppløst løst stoff som fortrenger løsemiddelmolekyler på overflaten, hvor kokende inntreffer. Derfor krever det en høyere temperatur for nok løsemiddelmolekyler til å unnslippe for å fortsette kokende ved atmosfærisk trykk.
Anbefalt:
Hva er den matematiske sammenhengen mellom strømmotstand og spenningsdip?

Ohms lov. Forholdet mellom spenning, strøm og motstand er beskrevet av Ohms lov. Denne ligningen, i = v/r, forteller oss at strømmen, i, som strømmer gjennom en krets er direkte proporsjonal med spenningen, v, og omvendt proporsjonal med motstanden, r
Hva er de matematiske tegnene?

Grunnleggende matematiske symboler Symbol Symbol Navn Betydning / definisjon ≠ ikke likhetstegn ulikhet ≈ tilnærmet lik tilnærming > streng ulikhet større enn < streng ulikhet mindre enn
Hva er sammenhengen mellom statistikk i sannsynlighet?
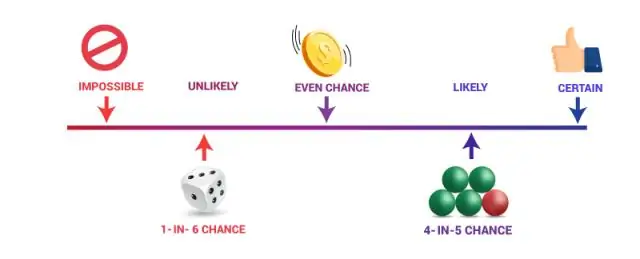
Sannsynlighet og statistikk er relaterte områder av matematikk som er opptatt av å analysere den relative frekvensen av hendelser. Sannsynlighet handler om å forutsi sannsynligheten for fremtidige hendelser, mens statistikk involverer analyse av frekvensen av tidligere hendelser
Hva er matematiske konvensjoner?

En matematisk konvensjon er et faktum, navn, notasjon eller bruk som er generelt enige om av matematikere. For eksempel det faktum at man evaluerer multiplikasjon før addisjon i uttrykket. er bare konvensjonell: det er ingenting i seg selv vesentlig med rekkefølgen av operasjoner
Hva er den lengste matematiske ligningen?

Hva er den lengste ligningen i verden? I følge Sciencealert inneholder den lengste matematiske ligningen rundt 200 terabyte med tekst. Kalt det boolske pythagoriske trippelproblemet, ble det først foreslått av den California-baserte matematikeren Ronald Graham, tilbake på 1980-tallet
