
- Forfatter Miles Stephen [email protected].
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:06.
Så vi regne ut det ved å ta vektet masse av hver av isotopene og legge dem sammen. Så for det første masse , vil vi multiplisere 0,50 % av 84 (amu - atommasse enheter) = 0,042 amu, og legg det til 9,9 % av 86 amu = 8,51 amu, og så videre.
Deretter kan man også spørre seg hvordan man beregner den gjennomsnittlige atommassen?
Beregning av gjennomsnittlig atommasse De gjennomsnittlig atommasse av et element er summen av masser av dens isotoper, hver multiplisert med sin naturlige overflod (desimaltall assosiert med prosent av atomer av det elementet som er av en gitt isotop). Gjennomsnittlig atommasse = f1M1 + f2M2 +…
Vet også hvilke tre typer informasjon som trengs for å beregne en gjennomsnittlig atommasse? Antall isotoper som eksisterer for elementet. De Atomisk Nummer for elementet. Den prosentvise overflod av hver isotop.
Man kan også spørre hvilken verdi som er nærmest atommassen til strontium?
Strontium . I sin rapport fra 1961 anbefalte kommisjonen Ar(Sr) = 87,62 basert på masse -spektrometrisk bestemmelse av Nier. Dette verdi ble revidert til Ar(Sr) = 87,62(1) i 1969 og den forblir uendret siden.
Hva har en masse på 1 amu?
En atommasseenhet (symbolisert AMU eller amu) er definert som nøyaktig 1/12 massen til et karbon-12-atom. Karbon-12 (C-12) atomet har seks protoner og seks nøytroner i sin kjerne. I upresise termer er en AMU gjennomsnittet av proton hvilemasse og nøytron hvilemasse.
Anbefalt:
Hva er den gjennomsnittlige dybden til CCD-kalsittkompensasjonsdybden)?

Kalsittkompensasjonsdybden ligger mellom 4 og 6 km i moderne hav, og aragonittkompensasjonsdybden (ACD) forekommer i gjennomsnitt omtrent 3 km over den (Morse og Mackenzie, 1990 og referanser deri)
Hva er den gjennomsnittlige tettheten til en nøytronstjerne?

Med disse betraktningene om våre usikkerheter i nøytronstjernemålinger, har den gjennomsnittlige nøytronstjernen en tetthet rundt 5 x 1017 kg/m3 i gjennomsnitt. Dette er ikke ensartet! Modeller anslår at tettheten er så lav som 109 kg/m3 på overflaten og så høy som 8 x 1017 kg/m3 ved kjernen
Hva er den gjennomsnittlige tettheten til Solen chegg?
Chegg.com. Gjennomsnittlig tetthet av solen er i størrelsesorden 103 kg/m3
Hvordan beregner du atommassen til bor?
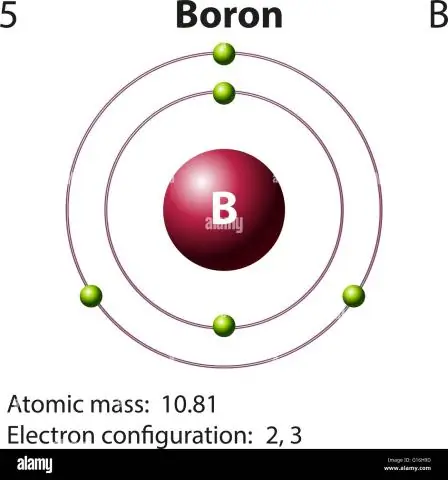
For bor vil denne ligningen se slik ut: 5 protoner + 5 nøytroner = 10 atommasseenheter (AMU) eller, for den mer vanlig forekommende borisotopen (ca. 5 protoner + 6 nøytroner = 11 AMU)
Hva er den gjennomsnittlige diameteren til en globus?

Standard 12-tommers globus. Globusene med 12-tommers diameter er standardstørrelsen i bordkloder og kjøpes oftest av våre kunder
