
- Forfatter Miles Stephen [email protected].
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:07.
La oss ta et eksempel på en buffer består av den svake basen ammoniakk , NH3 og dens konjugerte syre, NH4+. Når HCl (sterk syre) tilsettes dette buffer systemet, forbrukes de ekstra H+-ionene som legges til systemet av NH3 til form NH4+. Den videre tilsetningen av en syre eller base til buffer vil endre pH raskt.
Likeledes, er nh3 og NH4Cl en bufferløsning?
Svar og forklaring: Ammoniakk og ammoniumklorid buffer er en blanding av svak syre og dens salt. Det er en grunnleggende buffer fordi basedissosiasjonskonstanten for ammoniakk er større enn syrekonstanten for ammoniumioner.
På samme måte, hvilken type reaksjon er HCl og nh3? Og dermed NH3 ved mottak av H+ av HCl (H+ og Cl-) danner NH4+ (ammoniumion) som ved binding med Cl- ion (fra HCl ) gir NH4Cl (ammoniumklorid). De reaksjon er representert som NH3 + HCl = NH4Cl.
Spørsmålet er også, hvilken reaksjon skjer når HCl tilsettes ammoniakkbuffer?
Den saltsyre syre ville reagere voldsomt med ammoniakken for å danne ammoniumklorid (som er et veldig svakt surt salt, vanligvis ufarlig), nøytraliserer løsningens basicitet, og kraftig dannelse av hydrogengassbobler vil bli observert, som brusing av løsningen.
Hvordan lager du en ammoniakkbufferløsning?
Ammoniakk - Ammoniumklorid Buffer : Løs opp 67,5 g ammoniumklorid i ca. 200 ml vann, tilsett 570 ml sterk ammoniakkløsning og fortynn med vann til 1000 ml. Ammoniakkbuffer pH 9,5: Løs opp 33,5 g ammoniumklorid i ISO ml vann og 42 ml 10M ammoniakk og fortynn med vann til 250 ml.
Anbefalt:
Hvilken løsning er en buffer?

En bufferløsning er en som motstår endringer i pH når små mengder av en syre eller en alkali tilsettes den. Sure bufferløsninger. En sur bufferløsning er ganske enkelt en som har en pH mindre enn 7. Sure bufferløsninger er vanligvis laget av en svak syre og et av dens salter - ofte et natriumsalt
Hvorfor fungerer en buffer best ved en pH nær pKa?
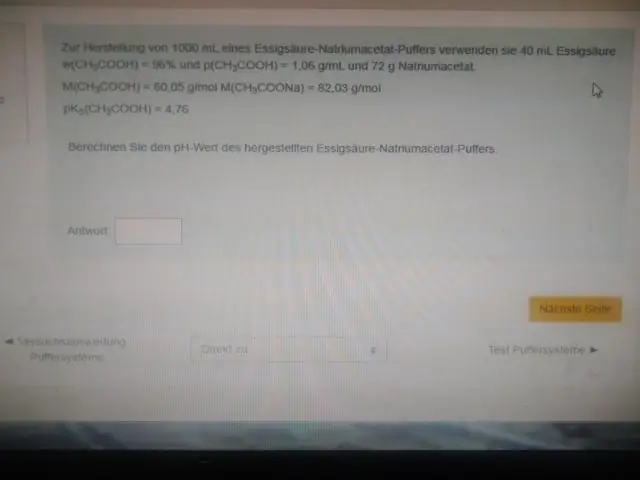
Med andre ord er pH i den ekvimolare løsningen av syre (f.eks. når forholdet mellom konsentrasjonen av syre og konjugatbase er 1:1) lik pKa. Denne regionen er den mest effektive for å motstå store endringer i pH når enten syre eller base tilsettes. En titreringskurve viser visuelt bufferkapasitet
Kan en sterk syre og svak base lage en buffer?

Som du har sett ved beregning av pH i løsninger, er bare en liten mengde av en sterk syre nødvendig for å drastisk endre pH. En buffer er ganske enkelt en blanding av en svak syre og dens konjugerte base eller en svak base og dens konjugerte syre. Buffere virker ved å reagere med eventuell tilsatt syre eller base for å kontrollere pH
Hva er funksjonen til PCR-buffer?

Opprinnelig besvart: Hva er rollen til en buffer i en PCR? Vanligvis er en buffer en løsning som kan motstå pH-endringer ved å kjemisk nøytralisere små mengder tilsatte sure eller basiske forbindelser, og dermed opprettholde den totale pH-en til et medium. Hvorfor er dette nødvendig for PCR? DNA er pH-sensitivt
Hva er et buffer Khan Academy?

Om transkripsjon. En bufferløsning inneholder en blanding av en svak syre og dens konjugerte base (eller en svak base og dens konjugerte syre). Likevekten mellom den svake syren og dens konjugerte base gjør at løsningen motstår endringer i pH når små mengder sterk syre eller base tilsettes
