
Innholdsfortegnelse:
- Forfatter Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:07.
An ionisk forbindelse er en kjempe struktur av ioner . De ioner har et vanlig, gjentatt arrangement kalt an ionisk gitter . Dette er hvorfor solid ioniske forbindelser danne krystaller med vanlige former.
Dessuten, hvorfor eksisterer ioniske forbindelser i et krystallinsk gitter?
Egenskapene til ioniske forbindelser følge av orden krystallgitter arrangement av tett bundne ladede partikler som utgjør dem. Ioniske forbindelser pleier å ha høye smelte- og kokepunkter, fordi attraksjonen mellom ioner i gitter er veldig sterk.
På samme måte, hva er ionegitter? An ionisk forbindelsen består av kationer og anioner i a gitter struktur. De ionisk gitter strukturen holdes sammen av de elektrostatiske tiltrekningskreftene mellom de motsatt ladede ioner . Et metall eller en metallegering består av metallkationer og et hav av delokaliserte elektroner.
Her, er alle ioniske forbindelser krystallinske?
Individuell ioner innenfor en ionisk forbindelse har vanligvis flere nærmeste naboer, så anses ikke å være en del av molekyler, men i stedet for en del av et kontinuerlig tredimensjonalt nettverk, vanligvis i et krystallinsk struktur. Ioniske forbindelser har vanligvis høye smelte- og kokepunkter, og er harde og sprø.
Hva er de 4 egenskapene til ioniske forbindelser?
Her er en kort liste over hovedegenskaper:
- De danner krystaller.
- De har høyere entalpier for fusjon og fordamping enn molekylære forbindelser.
- De er harde.
- De er sprø.
- De har høye smeltepunkter og også høye kokepunkter.
- De leder strøm, men bare når de er oppløst i vann.
Anbefalt:
Hva er tilstanden til ioniske forbindelser ved romtemperatur?

Kovalente bindinger vs ioniske bindinger Kovalente bindinger Ioniske bindinger Tilstand ved romtemperatur: flytende eller gassformig fast polaritet: lav høy
Hva er de strukturelle enhetene som utgjør ioniske forbindelser og hvordan de kalles?

For binære ioniske forbindelser (ioniske forbindelser som inneholder bare to typer elementer), navngis forbindelsene ved å skrive navnet på kationen først etterfulgt av navnet på anionet. For eksempel kalles KCl, en ionisk forbindelse som inneholder K+ og Cl-ioner, kaliumklorid
Hvorfor løses ioniske forbindelser lett opp i vann?

For å løse opp en ionisk forbindelse, må vannmolekylene kunne stabilisere ionene som oppstår ved å bryte ionbindingen. De gjør dette ved å hydrere ionene. Vann er et polart molekyl. Når du plasserer et ionisk stoff i vann, tiltrekker vannmolekylene de positive og negative ionene fra krystallen
Hvordan nevner du eksempler på ioniske forbindelser?

For binære ioniske forbindelser (ioniske forbindelser som inneholder bare to typer elementer), navngis forbindelsene ved å skrive navnet på kationen først etterfulgt av navnet på anionet. For eksempel kalles KCl, en ionisk forbindelse som inneholder K+ og Cl-ioner, kaliumklorid
Hvordan skriver du formler for binære ioniske forbindelser?
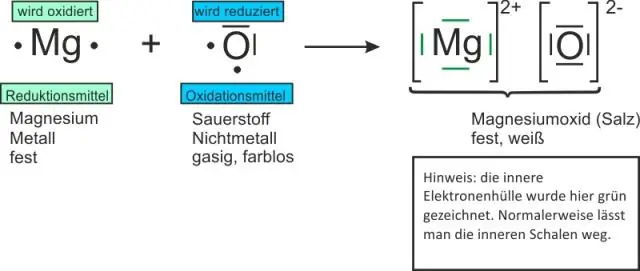
Formler for binære forbindelser begynner med metallet etterfulgt av ikke-metallet. Positive og negative ladninger må oppheve hverandre. Formler for ioniske forbindelser er skrevet med det laveste forholdet mellom ioner
