
- Forfatter Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:07.
De molekylæritet av en reaksjon er antall molekyler som reagerer i en elementær steg . En unimolekylær reaksjon er en der bare ett reagerende molekyl deltar i reaksjonen. To reaktantmolekyler kolliderer med hverandre i en bimolekylær reaksjon.
Med tanke på dette, hva er molekylæriteten til hver reaksjon?
De molekylæritet for en reaksjon er definert for Hver individuelle trinn i mekanismen til reaksjon . Det er lik antall molekyler som deltar (eller reagerer ) i Hver elementært trinn i mekanismen til reaksjon.
For det andre, hva er molekylæriteten og rateloven for hvert trinn? De molekylæritet av det elementære steg , og de involverte reaktantene, vil avgjøre hva takstloven vil være for akkurat det steg i mekanismen. Molekulæritet av elementært trinn og tilsvarende prislover : Den molekylæritet av en grunnskole steg i en reaksjonsmekanisme bestemmer formen på sin takstloven.
Dessuten, hvordan bestemmer du molekylæritet?
Generelt, molekylæritet av enkle reaksjoner er lik summen av antall molekyler av reaktanter involvert i den balanserte støkiometriske ligningen. De molekylæritet av en reaksjon er antall reaktantmolekyler som deltar i et enkelt trinn av reaksjonen.
Hva er et unimolekylært trinn?
Unimolekylære trinn er trinn som involverer bare én reaktant, bimolekylære trinn involverer 2 reaktanter. Hvis trinn er elementære trinn i en mekanisme, den molekylæritet er også reaksjonsrekkefølgen for hastigheten. Det er en unimolekylært elementær steg har en første ordre rate. 2.
Anbefalt:
Hva er de to hoveddelene av cellesyklusen og hva skjer med cellen i hvert trinn?
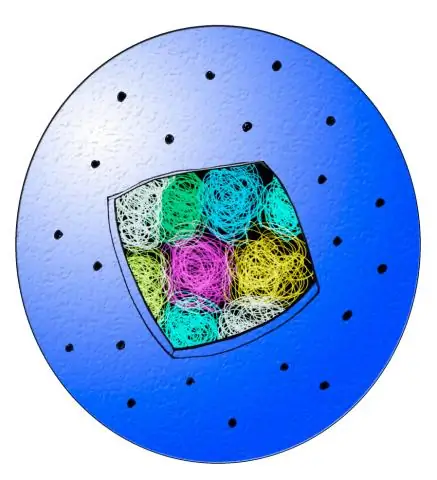
Det er to hovedstadier i cellesyklusen. Det første stadiet er interfase der cellen vokser og replikerer DNA. Den andre fasen er den mitotiske fasen (M-fasen) hvor cellen deler seg og overfører en kopi av sitt DNA til to identiske datterceller
Hvordan gjør du elektronkonfigurasjon trinn for trinn?

Trinn Finn atomets atomnummer. Bestem ladningen til atomet. Husk den grunnleggende listen over orbitaler. Forstå elektronkonfigurasjonsnotasjon. Husk rekkefølgen til orbitalene. Fyll ut orbitalene i henhold til antall elektroner i atomet ditt. Bruk det periodiske systemet som en visuell snarvei
Hva er 2 hoveddeler av cellesyklusen og hva skjer med cellen i hvert trinn?

Disse hendelsene kan deles i to hoveddeler: interfase (mellom delingene fasegruppering G1-fase, S-fase, G2-fase), hvor cellen dannes og fortsetter med sine normale metabolske funksjoner; den mitotiske fasen (M mitose), hvor cellen replikerer seg selv
Hvordan tegner du en ligning trinn for trinn?
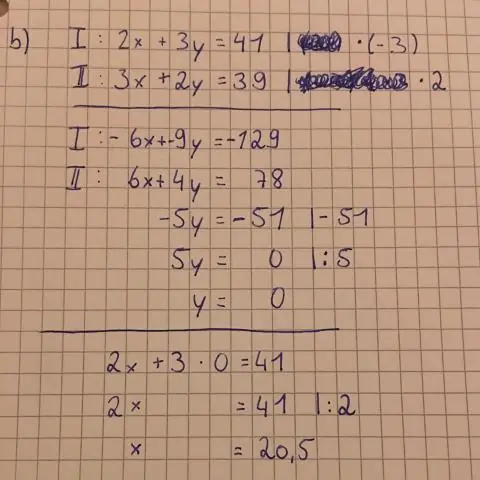
Her er noen trinn å følge: Plugg x = 0 inn i ligningen og løs for y. Plott punktet (0,y) på y-aksen. Plugg y = 0 inn i ligningen og løs for x. Plott punktet (x,0) på x-aksen. Tegn en rett linje mellom de to punktene
Hva er molekylæriteten til en reaksjon?

Molekulæritet. Molekulariteten til en reaksjon er definert som antall molekyler eller ioner som deltar i det hastighetsbestemmende trinnet. En mekanisme der to reagerende arter kombineres i overgangstilstanden til det hastighetsbestemmende trinnet kalles bimolekylær
