
- Forfatter Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:06.
EN molforhold er en konverteringsfaktor som relaterer beløpene inn føflekker av to stoffer i en kjemisk reaksjon. Tallene i en konverteringsfaktor kommer fra koeffisientene til den balanserte kjemiske ligningen. De følgende seks molforhold kan skrives for den ammoniakkdannende reaksjonen ovenfor.
Derav, hvordan finner du molforholdet?
- Start med antall gram av hvert element, gitt i oppgaven.
- Konverter massen til hvert grunnstoff til mol ved hjelp av molarmassen fra det periodiske systemet.
- Del hver molverdi med det minste antall beregnede mol.
- Avrund til nærmeste hele tall. Dette er molforholdet mellom elementene og er.
I tillegg, hvorfor er molforholdet viktig? Molforhold er viktig fordi molforhold lar deg endre føflekker av et stoff til føflekker av et annet stoff. De molforhold er magien som endres fra A til B. The molforhold kommer fra den kjemiske formelen eller ligningen.
hva er et molforhold?
de forhold mellom beløpene i føflekker av to forbindelser som er involvert i en kjemisk reaksjon. Molforhold brukes som konverteringsfaktorer mellom produkter og reaktanter i mange kjemiproblemer.
Hva er Mole-konvertering?
Konvertering fra føflekker til volum (liter): Multipliser din muldvarp verdi ved den molare volumkonstanten, 22,4L. Konvertering fra partikler (atomer, molekyler eller formelenheter) til føflekker : Del partikkelverdien din med Avogadros tall, 6,02×1023.
Anbefalt:
Hvordan skriver du formelen for en forbindelse som inneholder et polyatomisk ion?
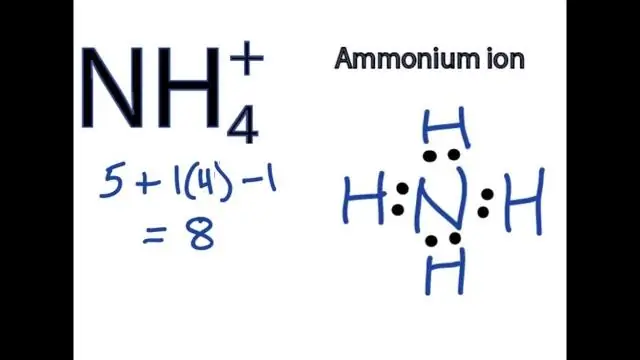
For å skrive formler for forbindelser som inneholder polyatomiske ioner, skriv symbolet for metallionet etterfulgt av formelen for det polyatomiske ionet og balanser ladningene. For å navngi en forbindelse som inneholder et polyatomisk ion, oppgi først kation og deretter anion
Hvordan skriver du A ikke likhetstegn på en Mac?

Matematisk For å danne ikke-lik-tegnet på et Mac-tastatur er snarveien Alternativ lik. En annen nyttig tastaturkombinasjon er Option ShiftEquals dette danner pluss- eller minustegnet
Hvordan skriver du PbO?

En beskrivelse av hvordan man skriver navnet på PbO, Bly(II)oksid. Først bestemmer vi om PbO er en ionisk eller molekylær (kovalent) forbindelse ved å bruke det periodiske systemet. Fra det periodiske systemet er Pb et metall og O er et ikke-metall. Derfor er PbO en ionisk forbindelse siden den består av et metall og ikke-metall
Hvordan skriver du en likning i punkthellingsform gitt to punkter?

Det er forskjellige former som vi kan skrive likningen til en linje: punkt-hellingsformen, helningsavskjæringsformen, standardformen osv. Ligningen til en linje gitt to punkter (x1, y1) og (x2, y2 ) som linjen går gjennom er gitt av, ((y - y1)/(x - x1)) / ((y2 - y1)/(x2 - x1))
Hva er et molforhold og hvordan brukes det i støkiometri?

Molforhold brukes som et middel for sammenligning av stoffer i en balansert kjemisk ligning for å bestemme mengder. Hvor mange mol hydrogengass er nødvendig for å reagere med 5 mol nitrogen. Vi kan bruke konverteringsfaktorer i en prosess som kalles støkiometri. Molforhold gir en sammenligning for å kansellere enheter
