
- Forfatter Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:06.
Det sentrale karbonet er sp-hybridisert, og de to terminale karbonatomene er sp2-hybridisert. Bindingsvinkelen dannet av de tre karbonatomene er 180°, noe som indikerer lineær geometri for det sentrale karbonatomet. De to terminale karbonatomene er plane, og disse planene er vridd 90° fra hverandre.
Hva er strukturen til Allene?
An allene er en forbindelse der ett karbonatom har dobbeltbindinger med hvert av sine to tilstøtende karbonsentre. Allenes er klassifisert som polyener med kumulerte diener. Moderforbindelsen til denne klassen er propadien, som i seg selv også kalles allene.
Foruten ovenfor, viser Allenes geometrisk isomerisme? Allenes kan ikke generere cis-trans isomerer , men de kan generere enantiomerer. Enhver cumulen med et oddetall dobbeltbindinger er geometrisk strukturert som etylen (de 4 atomene koblet til dobbeltbindingen ligger i samme plan som dobbeltbindingen) og er i stand til å ha ett par cis-trans isomerer.
Så, er Allene en planar?
Allene er ikke plan på grunn av måten karbonatomene er bundet til sentralatomet på. Mer spesifikt, Allene inneholder to karboner bundet til hver side av det sentrale karbonet med en dobbeltbinding, som grovt sett kan oversettes til en pi-binding.
Hvorfor er Allenes ustabile?
An Allene har to π-bindinger. Interessant nok er de to π-bindingene vinkelrett på hverandre, på grunn av hvilket det ikke er noen overlapping av de ledige p-orbitalene, noe som til slutt fører til ingen delokalisering av elektroner. Dette står for ustabiliteten til allenes.
Anbefalt:
Hva er hensikten med geometriske konstruksjoner?

'Konstruksjon' i geometri betyr å tegne former, vinkler eller linjer nøyaktig. Disse konstruksjonene bruker kun kompass, rettekant (dvs. linjal) og blyant. Dette er den "rene" formen for geometrisk konstruksjon: ingen tall involvert
Hvordan skiller formen til en plantecelle seg fra den til en dyrecelle?
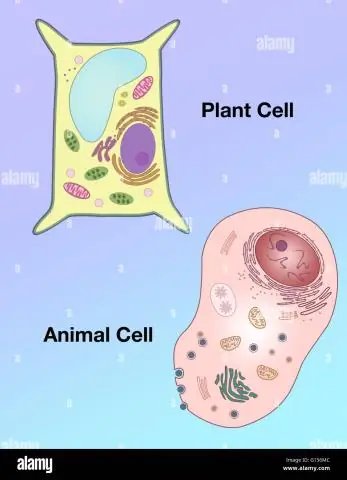
Vakuoler: Planteceller har en stor vakuol, mens dyreceller inneholder flere små vakuoler. Form: Planteceller har en mer regelmessig form (vanligvis rektangulær), mens dyreceller har uregelmessige former. Lysosomer: er vanligvis tilstede i dyreceller, mens de er fraværende i planteceller
Hva er det geometriske gjennomsnittet av 4 og 18?

+15. Muxakara og 15 andre lærte av dette svaret. √(4×18)= √72 eller √36√2= 6√2 forenklet
Hva er de geometriske konseptene?

Noen grunnleggende geometrikonsepter, ord og notasjoner som du trenger å vite er punkter, linjer, linjestykker, midtpunkter, stråler, plan og rom
Hva er årsaken til endringen i formen til cellen?

Tre generelle faktorer bestemmer celleformen: tilstanden til cytoskjelettet, mengden vann som pumpes inn i en celle, og tilstanden til celleveggen. Hver av disse tre faktorene er svært dynamiske, noe som betyr at de er konstant i endring eller kan plutselig endres. Denne dynamikken er hvordan celler kan variere i form
