
- Forfatter Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:06.
Her må vi bryte C=C knytte bånd i eten, og H-H knytte bånd i H2. (Se Bond energi tabell nederst på denne siden) A H-H knytte bånd entalpi (BE) er 436 kJ/mol, en C=C knytte bånd er 602 kJ/mol, a C-C binding er 346 kJ/mol, og en CH BE er 413 kJ/mol.
På samme måte spørs det, hva er bindingsdissosiasjonsenergien for CC?
Vanlige bindingsenergier (D
| Knytte bånd | D (kJ/mol) | r (pm) |
|---|---|---|
| C-C | 346 | 154 |
| C=C | 602 | 134 |
| C≡C | 835 | 120 |
| C-Si | 318 | 185 |
Vet også, hva er bindingsenergien til CO? De bindingsenergi av C=O, dvs energi endring for reaksjonen CO (g) → C(g) + O(g) er 1079 kJ/mol. Dette er den sterkeste knytte bånd kjent for et diatomisk molekyl. Men dette er atypisk på en måte, siden det er mer en trippel knytte bånd enn en dobbel knytte bånd.
På denne måten, hvordan beregner du bindingsenergi?
Bond energi er definert av summen av alle obligasjoner brutt minus summen av alle obligasjoner dannet: ΔH = ∑H( obligasjoner gått i stykker) - ∑H( obligasjoner dannet). ΔH er endringen i bindingsenergi , også referert til som knytte bånd entalpi og ∑H er summen av bindingsenergier for hver side av ligningen.
Hvilken binding er sterkere CC eller CO?
Hvordan er C-O-binding sterkere enn C-C binding , men C-N knytte bånd er svakere enn begge disse obligasjoner ? Det er fornuftig det C-O er sterkere enn C-C . Forskjellen i elektronegativitet er større, noe som øker ionisk karakter mens oksygenatomet er mindre, noe som øker orbital overlapping.
Anbefalt:
Hva er forskjellen mellom linje til linje spenning og linje til nøytral spenning?

Spenningen mellom to linjer (for eksempel 'L1' og 'L2') kalles linje til linje (eller fase til fase) spenning. Spenningen over hver vikling (for eksempel mellom 'L1' og 'N' kalles linjen til nøytral (eller fasespenning)
Legger du til en syre til en base eller en base til en syre?

Tilsetning av en syre øker konsentrasjonen av H3O+-ioner i løsningen. Tilsetning av en base reduserer konsentrasjonen av H3O+ ioner i løsningen. En syre og en base er som kjemiske motsetninger. Hvis en base tilsettes til en sur løsning, blir løsningen mindre sur og beveger seg mot midten av pH-skalaen
Hva er forskjellen mellom massen til et proton og massen til et elektron?
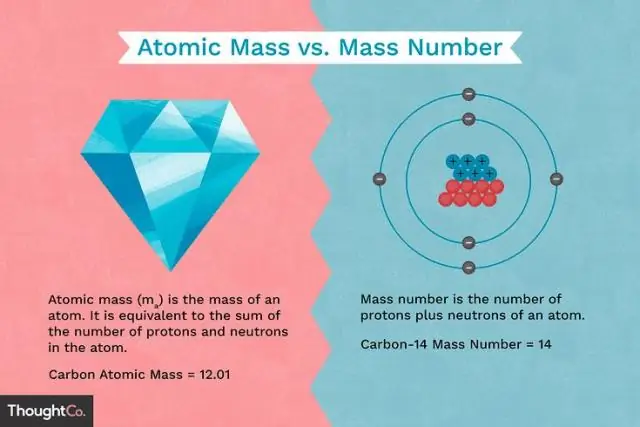
Protoner og nøytroner har omtrent samme masse, men de er begge mye mer massive enn elektroner (omtrent 2000 ganger så massive som et elektron). Den positive ladningen på et proton er lik den negative ladningen på et elektron
Hvilken bølgelignende egenskap til lys får det til å endre retning når det beveger seg fra et medium til et annet?

Refraksjon
Hva skjer med bindingsenergien når massetallet øker?
Figuren ovenfor illustrerer at når atommassetallet øker, synker bindingsenergien per nukleon for A > 60. Med andre ord har BE/A redusert. BE/A til en kjerne er en indikasjon på graden av stabilitet. Generelt har de mer stabile nuklidene høyere BE/A enn de mindre stabile
