
- Forfatter Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:06.
Den molare massen av H2SO4 er 98. Forklaringen er som følger H =1×2=2, S=32, O=16×4=64 Addisjonen av disse vil gi 98.
Også å vite er, hva er MR for h2so4?
98,079 g/mol
På samme måte, hvilken informasjon gir formelen h2so4? Dens kjemiske formel er H2SO4 . Det er et av kjemisk industris toppprodukter. Den kan brukes i prosessering, gjødselproduksjon, oljeraffinering og mye mer. Svovelsyre er en etsende mineralsyre som brukes i laboratorier, batterier og produksjon.
På samme måte kan du spørre, hva er prosentandelen av h2so4?
Prosentvis sammensetning etter element
| Element | Symbol | Masseprosent |
|---|---|---|
| Hydrogen | H | 2.055% |
| Oksygen | O | 65.251% |
| Svovel | S | 32.693% |
Hvor mange atomer er det i h2so4?
En svovelholdig ( H2SO4 ) molekylet har 2hydrogen atomer , 1 svovelatom og 4 oksygen atomer . Du kan også si en mol av svovelsyre har to mol hydrogen atomer , 1 mol svovel atomer og 4 mol oksygen atomer . Så totalt har vi 7 mol av atomer . Men det er i 1 mol av svovelsyre.
Anbefalt:
Hva er forskjellen mellom linje til linje spenning og linje til nøytral spenning?

Spenningen mellom to linjer (for eksempel 'L1' og 'L2') kalles linje til linje (eller fase til fase) spenning. Spenningen over hver vikling (for eksempel mellom 'L1' og 'N' kalles linjen til nøytral (eller fasespenning)
Legger du til en syre til en base eller en base til en syre?

Tilsetning av en syre øker konsentrasjonen av H3O+-ioner i løsningen. Tilsetning av en base reduserer konsentrasjonen av H3O+ ioner i løsningen. En syre og en base er som kjemiske motsetninger. Hvis en base tilsettes til en sur løsning, blir løsningen mindre sur og beveger seg mot midten av pH-skalaen
Hva er forskjellen mellom massen til et proton og massen til et elektron?
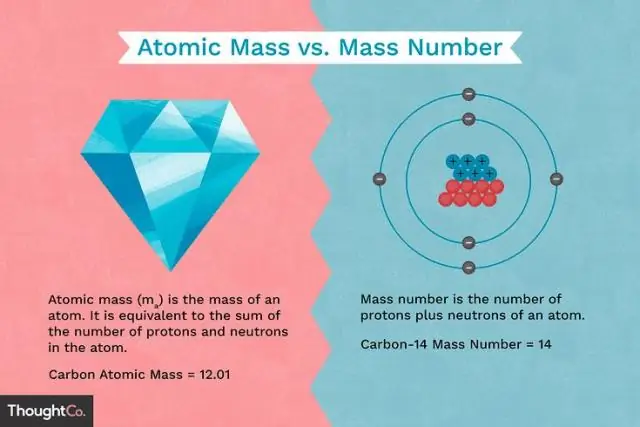
Protoner og nøytroner har omtrent samme masse, men de er begge mye mer massive enn elektroner (omtrent 2000 ganger så massive som et elektron). Den positive ladningen på et proton er lik den negative ladningen på et elektron
Hvilken bølgelignende egenskap til lys får det til å endre retning når det beveger seg fra et medium til et annet?

Refraksjon
Hva er RFM i kjemi?

Tallet du får kalles den relative formelmassen. Det er massen til én mol av forbindelsen i gram. Den relative formelmassen kan skrives som Mr eller RFM. For eksempel er massen til ett mol karbondioksid (CO2). (1 x RAM karbon) + (2 x RAM oksygen)
