
- Forfatter Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:06.
Kloret isotop med 18 nøytroner har en overflod på 0,7577 og et massetall på 35 amu. For å beregne gjennomsnitt atommasse, gang brøken med massetallet for hver isotop , og legg dem deretter sammen.
På samme måte, hva er det vektede gjennomsnittet av alle isotopene til et element?
Bruke massene til de forskjellige isotoper og hvor rikelig hver isotop er, kan vi finne gjennomsnitt massen til atomene til en element . Atommassen til en element er den vektlagt gjennomsnitt massen av atomene i en naturlig forekommende prøve av element . Atommasse rapporteres vanligvis i atommasseenheter.
hva har en masse på 1 amu? En atommasseenhet (symbolisert AMU eller amu) er definert som nøyaktig 1/12 massen til et karbon-12-atom. Karbon-12 (C-12) atomet har seks protoner og seks nøytroner i sin kjerne. I upresise termer er en AMU gjennomsnittet av proton hvilemasse og nøytron hvilemasse.
For det andre, hvordan beregner du prosentandel ved å bruke atommasse?
Endre hver prosent overflod til desimalform ved å dele på 100. Multipliser denne verdien med atommasse av den isotopen. Legg sammen for hver isotop for å få gjennomsnittet atommasse.
Hva er forskjellen mellom atommasse og atomvekt?
Atommasse (men) er den masse av en atom . En eneste atom har et bestemt antall protoner og nøytroner, så masse er utvetydig (vil ikke endres) og er summen av antall protoner og nøytroner i atomet . Atomvekt er et vektet gjennomsnitt av masse av alle atomer av et grunnstoff, basert på mengden av isotoper.
Anbefalt:
Hva er det geometriske gjennomsnittet av 4 og 18?

+15. Muxakara og 15 andre lærte av dette svaret. √(4×18)= √72 eller √36√2= 6√2 forenklet
Hvordan finner du det manglende tallet når du får gjennomsnittet?

Gjennomsnittet av et sett med tall er gjennomsnittet av disse tallene. Du kan finne middelverdien ved å legge til settet med tall og dele på hvor mange tall som er gitt. Hvis du blir gitt themean og bedt om å finne et manglende tall fra denne sett, bruk en enkel ligning
Hvordan finner du gjennomsnittet på en graf?
For å finne gjennomsnittet, legg til tallene og del summen på antall tillegg
Hvordan finner du gjennomsnittet og medianen i tablået?
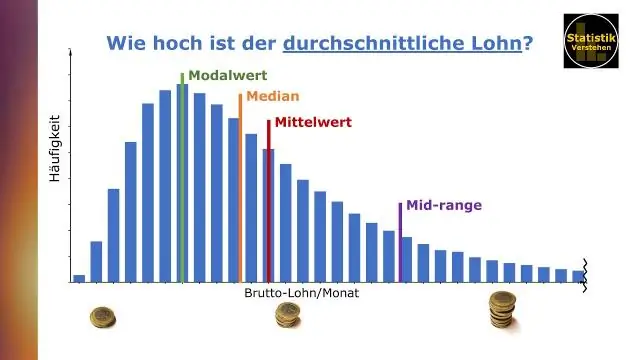
Kommunisere data med Tableau av Ben Jones Gjennomsnittet (eller gjennomsnittet) bestemmes ved å summere alle verdiene i et datasett og dele på antall verdier. Medianen er den midterste verdien i et datasett der verdiene er plassert i størrelsesorden
Hvordan finner du gjennomsnittet ved å bruke Excel?
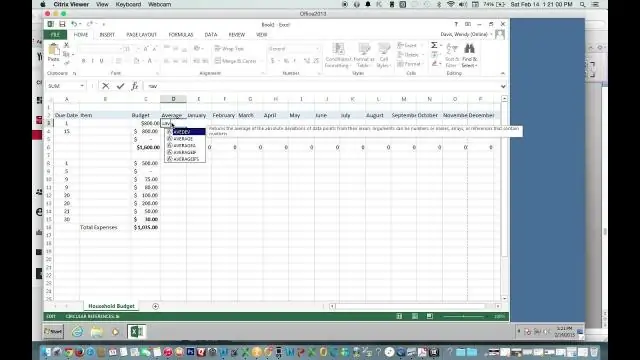
Bruk Autosum for raskt å finne gjennomsnittet Klikk på en celle under kolonnen eller til høyre for raden med tallene du vil finne gjennomsnittet for. På HJEM-fanen klikker du på pilen ved siden av Autosum > Gjennomsnitt, og trykker deretter på Enter
