
- Forfatter Miles Stephen [email protected].
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:07.
De Arrhenius-ligningen er k = Ae^(-Ea/RT), hvorA er Frekvens eller før- eksponentiell faktor ande^(-Ea/RT) er brøkdelen av kollisjoner som har nok energi å reagere (dvs. ha energi større enn eller lik aktiveringsenergi Ea) ved temperaturT.
Bare så, hva er frekvensfaktoren for en reaksjon?
Temperaturavhengighet av Reaksjoner I en første rekkefølge reaksjon , enhetene til pre-eksponentialen faktor er gjensidige sekunder. Den pre-eksponentielle faktor , A, er en konstant som kan utledes eksperimentelt eller numerisk. Det kalles også frekvensfaktor , og beskriver antall ganger to molekyler kolliderer.
hva er frekvensfaktoren i kjemi? De frekvensfaktor brukes til å beskrive frekvensen av molekylære kollisjoner som oppstår i kjemisk reaksjon. Den frekvensfaktor oppnås vanligvis eksperimentelt for å sikre at mengdene av a kjemisk reaksjon (temperatur, aktiveringsenergi og hastighetskonstant) passer til formen til Arrhenius-ligningen.
Deretter kan man også spørre seg hvordan man beregner aktiveringsenergi?
Verdien av helningen (m) er lik -Ea/R hvor R er en konstant lik 8,314 J/mol-K. De aktiveringsenergi kan også finnes algebraisk ved å erstatte to hastighetskonstanter (k1, k2) og de to tilsvarende reaksjonstemperaturene (T1, T2) inn i Arrhenius Ligning (2).
Hvordan regner du ut en pre-eksponentiell faktor?
- k er hastighetskonstanten, i enheter av 1M1−m−n⋅s, hvor m og n er rekkefølgen til henholdsvis reaktant A og B i reaksjonen.
- A er den pre-eksponensielle faktoren, som korrelerer med antall korrekt orienterte kollisjoner.
Anbefalt:
Hvordan finner du molekylvekten til NaOH?

Svar og forklaring: Den molare massen av natriumhydroksid tilsvarer 39,997 g/mol. For å bestemme den molare massen, multipliser atommassen med antall atomer i formelen
Hvordan finner du gjennomsnittshastighet med to hastigheter?
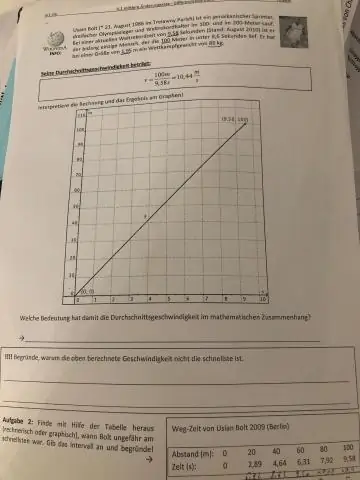
Summen av start- og slutthastigheten deles på 2 for å finne gjennomsnittet. Gjennomsnittshastighetskalkulatoren bruker formelen som viser gjennomsnittshastigheten (v) er lik summen av slutthastigheten (v) og starthastigheten (u), delt på 2
Hvordan finner du egenvekten til en flytende blanding?

Del nå den totale tettheten med tettheten til vann og du får SG av blandingen. Hva er væsken med høyest tetthet? Når likt volum av to stoffer blandes, er spesifikk vekt til blandingen 4. En masse av en væske med tetthet p blandes med en lik masse av en annen væske med tetthet 3p
Hvordan finner du loggbase 2 av 10?

Log102=0,30103 (ca.) Base-10-logaritmen av 2 er tallet x slik at 10x=2. Du kan beregne logaritmer for hånd ved å bruke bare multiplikasjon (og dividere med potenser av 10 - som bare er sifferforskyvning) og det faktum at log10(x10)=10⋅log10x, selv om det ikke er veldig praktisk
Hvordan finner du ut om en funksjon har en horisontal tangentlinje?

Horisontale linjer har en helning på null. Derfor, når den deriverte er null, er tangentlinjen horisontal. For å finne horisontale tangentlinjer, bruk den deriverte av funksjonen for å finne nullene og koble dem tilbake til den opprinnelige ligningen
