Innholdsfortegnelse:
- Forfatter Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:07.
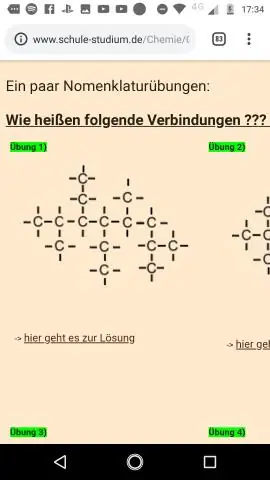
Molekylære formler fortelle deg hvor mange atomer av hvert grunnstoff er i en forbindelse, og empiriske formler fortelle deg det enkleste eller mest reduserte forholdet mellom elementer i en forbindelse. Hvis en forbindelse er molekylær formel kan ikke reduseres mer, da empirisk formel er det samme som molekylær formel.
Ganske enkelt, hvordan finner du molekylformelen fra den empiriske formelen?
Del molmassen til forbindelsen med empirisk formel masse. Resultatet skal være et helt tall eller svært nær et helt tall. Multipliser alle abonnementene i empirisk formel med hele tallet funnet i trinn 2. Resultatet er molekylær formel.
hva er den empiriske formelen til en forbindelse hvis molekylformel er s6o9? hvis molekylformel er S6O9 å få empirisk formel vi ser etter et tall som vil dele inn i 6 og 9 til fem det minste hele tallforholdet (som er definisjonen av empirisk formel !).
Enkelt sagt, hvordan finner du molekylformelen fra den empiriske formelen og molarmassen?
Empirisk formel vekt = (1 x 12,01 g/mol) + (2 x 1,01 g/mol) + (1 x 16,00 g/mol) = 30,02 g/mol. Del opp molar masse for molekylær formel ved empirisk formel masse . Resultatet avgjør hvor mange ganger abonnementene skal multipliseres i empirisk formel å få molekylær formel.
Hvordan løser du for empirisk formel?
Beregning av en empirisk formel
- Trinn 1: Få massen av hvert element tilstede i gram. Grunnstoff % = masse i g = m.
- Trinn 2: Bestem antall mol av hver type atom som er tilstede.
- Trinn 3: Del antall mol av hvert element med det minste antallet mol.
- Trinn 4: Konverter tall til hele tall.
Anbefalt:
Hva betyr bokstavene og tallene i en kjemisk formel?

Bokstavene i en kjemisk formel er symbolene for de spesifikke elementene. Bokstavene viser at den inneholder hydrogen, svovel og oksygen, og tallene viser at det er to hydrogenatomer, ett svovelatom og fire oksygenatomer per molekyl
Hvordan skrives molekylformel?

En molekylformel består av de kjemiske symbolene for de inngående elementene etterfulgt av numeriske subskripter som beskriver antall atomer til hvert element som er tilstede i molekylet. Den empiriske formelen representerer det enkleste hele-heltallsforholdet mellom atomer i en forbindelse
Hva er CL kjemisk formel?
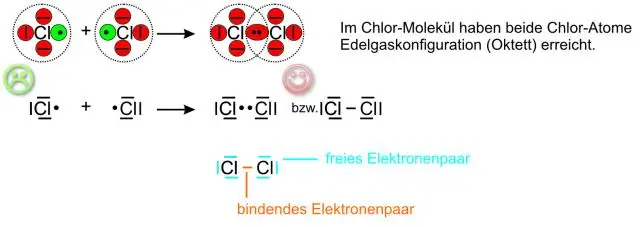
Kloridnavn Kjemisk formel Cl − Molar masse 35,45 g·mol−1 konjugatsyre Hydrogenklorid Termokjemi
Hvordan skriver du en empirisk formel med prosenter?

Transkripsjon Del hver % av grunnstoffets atommasse. Del hvert av DISSE svarene med det minste. Juster disse tallene til deres laveste hele tallforhold
Hva betyr empirisk regel?

Definisjon av den empiriske regelen Den empiriske regelen sier at for en normalfordeling vil nesten alle dataene falle innenfor tre standardavvik fra gjennomsnittet. Den empiriske regelen kan deles inn i tre deler: 68 % av dataene faller innenfor det første standardavviket fra gjennomsnittet
