
Innholdsfortegnelse:
- Forfatter Miles Stephen [email protected].
- Public 2024-01-18 08:18.
- Sist endret 2025-01-22 17:07.
Veiledning for oppløsningsvarme eller entalpi av løsningskjemi
- Mengden energi som frigjøres eller absorberes, beregnes. q = m × Cg × ΔT. q = mengden energi som frigjøres eller absorberes.
- regne ut mol oppløst stoff. n = m ÷ M. n = mol oppløst stoff.
- Mengde energi ( varme ) frigjort eller absorbert per mol oppløst stoff beregnes. ΔHsoln = q ÷ n.
Enkelt sagt, hvordan beregner du løsningsvarmen i kJ mol?
Entalpi av løsning (oppløsningsvarme) Eksempel
- Beregn varmen som frigjøres, q, i joule (J), ved reaksjonen: q = masse (vann) × spesifikk varmekapasitet (vann) × endring i temperatur (løsning)
- Beregn antall mol oppløst stoff (NaOH(s)): mol = masse ÷ molar masse.
- Beregn entalpiendringen, ΔH, i kJ mol-1 av oppløst stoff:
hva er løsningsvarmen av NaOH? Den aksepterte verdien for varme av løsning av NaOH er 44,2 kJ/mol og for NH4NO3 er den 25,4 kJ/mol.
Deretter kan man også spørre seg, hvordan beregner man varmeabsorbert?
De varme absorbert er regnet ut ved å multiplisere molene vann med molaren varme av fordampning. 5. Damp varmes opp fra 100oC til 140oC. De varme absorbert er regnet ut ved å bruke den spesifikke varme av damp og ligning ΔH=cp×m×ΔT.
Hva er den spesifikke varmen til NaOH?
Minimumstemperatur som starttemperatur=43,5°C. Tetthet av HCl & NaOH Oppløsning = 1,04 g/ml. Spesifikk varme av HCl & NaOH Løsning = 4,017 J/g°C.
Anbefalt:
Hvordan beregner man standardavvik fra PMP?

Formelen som brukes i PMBOK for standardavvik er enkel. Det er bare (P-O)/6. Det er det pessimistiske aktivitetsestimatet minus det optimistiske aktivitetsestimatet delt på seks. Problemet er at denne formen på ingen måte gir et mål på standardavvik
Hvordan beregner du jordens omkrets på breddegraden?

Omkretsen til en sirkel er lik 2πr hvor r er dens radius. På jorden er omkretsen av sfæren ved en gitt breddegrad 2πr(cos θ) hvor θ er breddegraden og r er jordens radius ved ekvator
Hvordan beregner du frekvens fra frekvens og prosent?
For å gjøre dette, del frekvensen på det totale antallet resultater og multipliser med 100. I dette tilfellet er frekvensen på den første raden 1 og det totale antallet resultater er 10. Prosentandelen vil da være 10,0. Den siste kolonnen er Kumulativ prosentandel
Hvordan beregner du potensielt fall i en krets?
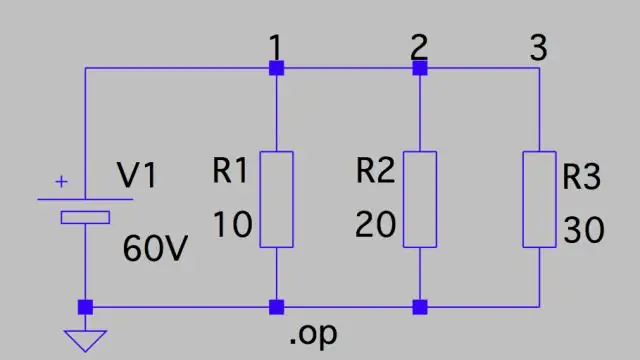
Spenningsfall: Parallell krets Dette betyr at spenningsfallet over hver er bare den totale spenningen til kretsen delt på antall motstander i kretsen, eller 24 V/3 = 8 V
Hvordan beregner du prosentandel av klor?

Klorisotopen med 18 nøytroner har en overflod på 0,7577 og et massetall på 35 amu. For å beregne gjennomsnittlig atommasse, multipliser brøken med massetallet for hver isotop, og legg dem sammen
