
- Forfatter Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:06.
I endotermisk reaksjoner entalpien til produktene er større enn entalpien til reaktantene. Fordi reaksjoner slipper ut eller absorbere energi , de påvirke de temperatur av sine omgivelser. Eksotermisk reaksjoner varme opp omgivelsene mens de er endotermiske reaksjoner kjøl dem ned.
På samme måte kan du spørre hvordan energi frigjøres eller absorberes under en kjemisk reaksjon?
Energi og Kjemiske reaksjoner Energi brukes til å bryte bindinger i reaktanter, og energi frigjøres når nye bindinger dannes i produkter. I andre kjemiske reaksjoner , det krever mer energi å bryte bindinger i reaktanter enn det er løslatt når bindinger dannes i produkter. Disse reaksjoner , kalt endotermisk reaksjoner , absorbere energi.
På samme måte, hvilke energiendringer skjer i kjemiske reaksjoner? Kjemiske reaksjoner involverer ofte Endringer i energi på grunn av brudd og dannelse av bindinger. Reaksjoner i hvilken energi frigjøres er eksoterme reaksjoner , mens de som tar inn varme energi er endoterme.
Med tanke på dette, hvordan endres temperaturen under en kjemisk reaksjon?
Hvis to stoffer reagerer og temperatur av blandingen avtar, den reaksjon er endotermisk. Hvis to stoffer reagerer og temperatur av blandingen øker reaksjon er eksoterm. EN kjemisk reaksjon innebærer brudd av bånd i reaktantene og dannelsen av bindinger i produktene.
Hvordan endres energi fra en form til en annen i en eksoterm reaksjon?
An eksoterm reaksjon er en som slipper energi i form av varme eller lys. I andre reaksjoner , den energi som må absorberes for å bryte bindingene i reaktantene, er mer enn energi at er frigjøres når de nye bindingene i produktene dannes.
Anbefalt:
Hvordan er fusjon forskjellig fra en kjemisk reaksjon?

Fusjon er ikke en kjemisk reaksjon. Det er en kjernefysisk reaksjon. I kjemiske reaksjoner endres ikke kjerner
Hva er ikke atomer under en kjemisk reaksjon?

Atomer skapes ikke eller ødelegges under en kjemisk reaksjon. Forskere vet at det må være SAMME antall atomer på hver side av LIGNING. For å balansere den kjemiske ligningen må du legge til KOEFFICIENTER foran de kjemiske formlene i ligningen. Du kan ikke LEGG TIL eller ENDRE abonnementer
Hvilken type organisme bruker energi fra sollys og konverterer den til kjemisk energi?
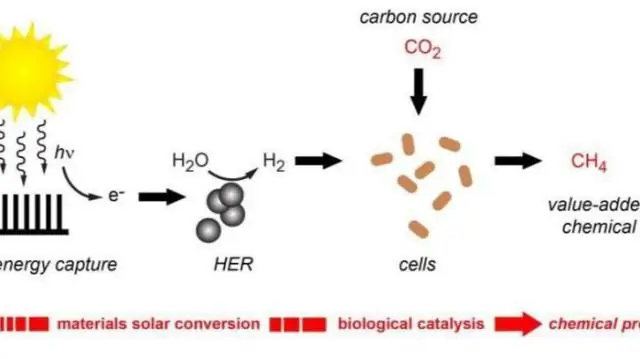
Fotosyntese er prosessen der organismer som inneholder pigmentet klorofyll omdanner lysenergi til kjemisk energi som kan lagres i molekylære bindinger til organiske molekyler (f.eks. sukker)
Hvilke faktorer påvirker hastigheten på en kjemisk reaksjon?

Faktorene som påvirker reaksjonshastigheter er: overflateareal av en fast reaktant. konsentrasjon eller trykk av en reaktant. temperatur. naturen til reaktantene. tilstedeværelse/fravær av en katalysator
Hva er en kjemisk reaksjon og en fysisk reaksjon?

Forskjellen mellom en fysisk reaksjon og en kjemisk reaksjon er sammensetningen. I en kjemisk reaksjon skjer det en endring i sammensetningen av de aktuelle stoffene; i en fysisk endring er det en forskjell i utseende, lukt eller enkel visning av en prøve av stoffet uten endring i sammensetningen
