
- Forfatter Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:06.
De kovalent feste av et annet molekyl kan endre de aktivitet av enzymer og mange andre proteiner. I disse tilfellene gir et donormolekyl en funksjonell del som modifiserer egenskapene til enzym . Fosforylering og defosforylering er de vanligste, men ikke de eneste måtene kovalent modifikasjon.
Også å vite er, hva er kovalent modifikasjon?
Kovalente modifikasjoner er enzymkatalyserte endringer av syntetiserte proteiner og inkluderer tillegg eller fjerning av kjemiske grupper. Modifikasjoner kan målrette mot en enkelt type aminosyre eller flere aminosyrer og vil endre de kjemiske egenskapene til stedet.
I tillegg, hva er enzymmodifikasjon? Enzymmodifikasjon : endring av enzym struktur og dermed dens funksjon og dens katalytiske aktivitet for å produsere nye metabolitter for å tillate nye katalyserte reaksjonsveier.
Så er kovalent modifikasjon reversibel?
Akseptoren er vanligvis en serin-, treonin- eller tyrosinrest, aminosyrer som inneholder hydroksid. Prosessen med kovalent modifikasjon kan være reversible , men ikke i alle tilfeller. Et vanlig eksempel på kovalent regulering er proteinfosforylering.
Er acetylering en kovalent modifikasjon?
N-terminal acetylering er en av de vanligste co-translasjonelle kovalente modifikasjoner av proteiner i eukaryoter, og det er avgjørende for reguleringen og funksjonen til ulike proteiner. N-terminal acetylering spiller en viktig rolle i syntese, stabilitet og lokalisering av proteiner.
Anbefalt:
Hvordan forklarer naturlig utvalg nedstigning med modifikasjon?
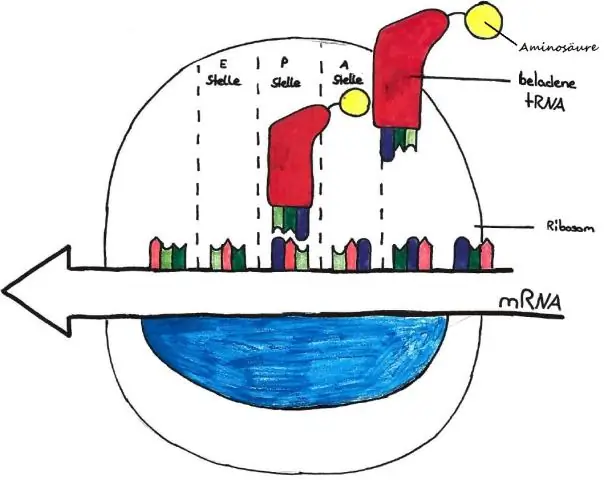
Nedstigning med modifikasjon er den evolusjonære mekanismen som produserer endring i den genetiske koden til levende organismer. Det er tre mekanismer for slike endringer, og den fjerde mekanismen, naturlig seleksjon, bestemmer hvilke etterkommere som overlever for å overføre genene sine, basert på miljøforhold
Hva er naturlig utvalg og hvordan forholder det seg til nedstigning med modifikasjon?

Nedstigning med modifikasjon er den evolusjonære mekanismen som produserer endring i den genetiske koden til levende organismer. Det er tre mekanismer for slike endringer, og den fjerde mekanismen, naturlig seleksjon, bestemmer hvilke etterkommere som overlever for å overføre genene sine, basert på miljøforhold
Hvordan måler du hastigheten på enzymaktivitet?

Enzymanalyse Enzymanalyser er laboratoriemetoder for å måle enzymatisk aktivitet. Mengden eller konsentrasjonen av et enzym kan uttrykkes i molare mengder, som med alle andre kjemikalier, eller i form av aktivitet i enzymenheter. Enzymaktivitet = mol substrat konvertert per tidsenhet = hastighet × reaksjonsvolum
Hvordan påvirkes enzymaktivitet av temperatur?

Enzymaktiviteten øker når temperaturen øker, og øker i sin tur reaksjonshastigheten. Dette betyr også at aktiviteten avtar ved kaldere temperaturer. Alle enzymer har en rekke temperaturer når de er aktive, men det er visse temperaturer hvor de fungerer optimalt
Hvordan endres enzymaktivitet når substratkonsentrasjonen avtar?

Hvis alle enzymene i et system er bundet til substrater, må ytterligere substratmolekyler vente på at et enzym blir tilgjengelig etter at en reaksjon er fullført. Dette betyr at reaksjonshastigheten vil avta når enzymkonsentrasjonen avtar
