
- Forfatter Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:06.
Kollisjonsteori , teori brukes til å forutsi prisene på kjemiske reaksjoner , spesielt for gasser. De kollisjonsteori er basert på antakelsen om at for en reaksjon for å oppstå er det nødvendig at de reagerende artene (atomer eller molekyler) kommer sammen eller kollidere med en annen.
Dessuten, hva er de 3 delene av kollisjonsteori?
Det er tre viktig deler til kollisjonsteori , at reagerende stoffer må kollidere , at de må kollidere med nok energi og det må de kollidere med riktig orientering.
Man kan også spørre, hvordan gjør man kollisjonsteori? Når en katalysator er involvert i kollisjon mellom reaktantmolekylene kreves det mindre energi for at den kjemiske endringen skal ta plass, og dermed mer kollisjoner har tilstrekkelig energi til at reaksjonen kan skje. Reaksjonshastigheten øker derfor. Kollisjonsteori er nært knyttet til kjemisk kinetikk.
hvordan forklarer kollisjonsteorien hastigheten på kjemisk reaksjon?
De kollisjonsteori sier det kjemisk reaksjon bare oppstå hvis det er det kollisjoner av de riktige energinivåene mellom molekyler og atomer. Det følger at hvis molekylene kollidere oftere at dette vil øke vurdere av reaksjon . Jo høyere temperatur, jo mer kinetisk energi har molekyler og atomer.
Hva er en vellykket kollisjon i kjemi?
Molekyler må kollidere med tilstrekkelig energi, kjent som aktiveringsenergien, slik at kjemisk bindinger kan bryte. Molekyler må kollidere med riktig orientering. EN kollisjon som oppfyller disse to kriteriene, og som resulterer i en kjemisk reaksjon, er kjent som en vellykket kollisjon eller en effektiv kollisjon.
Anbefalt:
Hva ville skje hvis det ikke var noen kjemiske reaksjoner?

Uten kjemiske reaksjoner ville ingenting noen gang endret seg. Atomer ville forbli atomer. Nye molekyler ville ikke dannes. Ingen organismer kunne leve
Hva er sant om kjemiske reaksjoner?

I en kjemisk reaksjon kan bare atomene som er tilstede i reaktantene havne i produktene. Ingen nye atomer skapes, og ingen atomer blir ødelagt. I en kjemisk reaksjon kommer reaktanter i kontakt med hverandre, bindinger mellom atomer i reaktantene brytes, og atomer omorganiseres og danner nye bindinger for å lage produktene
Hva er forskjellene mellom fysiske og kjemiske reaksjoner i kjemi?

Forskjellen mellom en fysisk reaksjon og en kjemisk reaksjon er sammensetningen. I en kjemisk reaksjon skjer det en endring i sammensetningen av de aktuelle stoffene; i en fysisk endring er det en forskjell i utseende, lukt eller enkel visning av en prøve av stoffet uten endring i sammensetningen
Hva er kjemiske symboler og kjemiske formler?
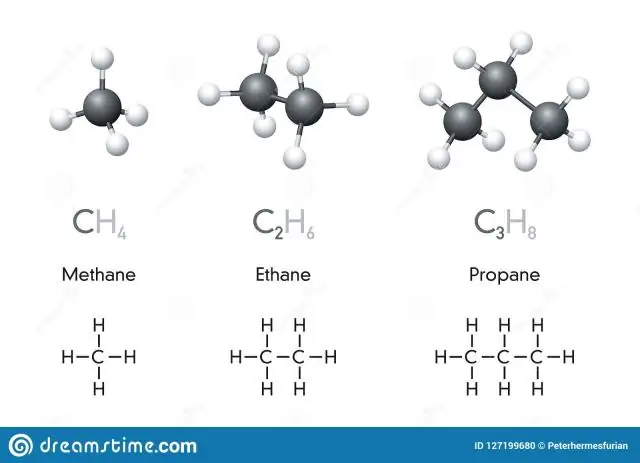
Et kjemisk symbol er en en- eller tobokstavsbetegnelse på et element. Forbindelser er kombinasjoner av to eller flere elementer. En kjemisk formel er et uttrykk som viser elementene i en forbindelse og de relative proporsjonene av disse elementene. Mange elementer har symboler som stammer fra det latinske navnet på elementet
Hva er en nøkkelforskjell mellom kjemiske og kjernefysiske reaksjoner Brainly?

(1) Kjernereaksjoner involverer en endring i et atoms kjerne, som vanligvis produserer et annet grunnstoff, sammen med utslipp av stråling som α,βogγ etc stråler. Kjemiske reaksjoner involverer på den annen side bare en omorganisering av elektroner og involverer ikke endringer i kjernene
