
- Forfatter Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:06.
Isotoper er atomer med samme antall protoner, men som har en annerledes antall nøytroner. Siden atomnummeret er lik antall protoner og atommassen er summen av protoner og nøytroner, kan vi også si at isotoper er elementer med samme atomnummer men annerledes massetall.
Deretter kan man også spørre, hvordan er isotoper av samme grunnstoff forskjellige?
Isotoper av en element vil inneholde samme antall protoner og elektroner, men vil variere i antall nøytroner de inneholder. Med andre ord, isotoper har samme atomnummer fordi de er samme element men har en annerledes atommasse fordi de inneholder en annerledes antall nøytroner.
For det andre, hva er forskjellen mellom atomer som har forskjellige atomnummer? De antall nøytroner er forskjell mellom massen Nummer og atomnummer . Atomer av forskjellige grunnstoffer er annerledes fordi de inneholder forskjellige antall protoner. Isotoper av samme element er annerledes fordi de har forskjellig antall nøytroner, og dermed har forskjellige atomnummer.
For det andre, hva er forskjellen mellom atom og isotop?
En spesiell atom vil ha samme nummer av protoner og elektroner og det meste atomer har minst like mange nøytroner som protoner. Alle isotoper av et bestemt element har samme nummer av protoner, men kan ha annerledes tall av nøytroner.
Hvorfor er det forskjellige isotoper av atomer?
Isotoper : Annerledes Typer av Atomer . Atomer i et kjemisk grunnstoff som har annerledes antall nøytroner enn protoner og elektroner kalles isotoper . Fordi den har samme antall protoner som elektroner, hydrogenet atom er nøytral (de positive og negative ladningene opphever hverandre).
Anbefalt:
Hvordan skiller tholeiittisk basalt seg fra de fleste vulkanske bergarter?

Bergarter i den tholeiitiske magmaserien er klassifisert som subalkaliske (de inneholder mindre natrium enn noen andre basalter) og skiller seg fra bergarter i den calc-alkaliske magmaserien ved redokstilstanden til magmaen de krystalliserte fra (tholeiittiske magmaer er redusert; calc- alkaliske magmaer oksideres)
Hvordan skiller formen til en plantecelle seg fra den til en dyrecelle?
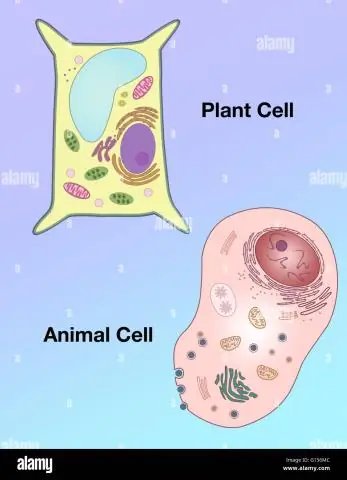
Vakuoler: Planteceller har en stor vakuol, mens dyreceller inneholder flere små vakuoler. Form: Planteceller har en mer regelmessig form (vanligvis rektangulær), mens dyreceller har uregelmessige former. Lysosomer: er vanligvis tilstede i dyreceller, mens de er fraværende i planteceller
Hvordan skiller en krystall av alun seg fra en krystall av kaliumaluminiumsulfat?

A) Svaret er: kaliumaluminiumsulfat er krystall med kubisk struktur, kaliumaluminiumsulfat dodekahydrat (alun) er hydrat (inneholder vann eller dets bestanddeler)
Hvilke to atomer er isotoper av samme grunnstoff?

Atomer av samme grunnstoff, som inneholder samme antall protoner, men forskjellig antall nøytroner, er kjent som isotoper. Isotoper av et gitt grunnstoff inneholder alle samme antall protoner, så de har samme atomnummer (for eksempel er atomnummeret til helium alltid 2)
Hvordan skiller de tre typene konvergerende grenser seg fra hverandre?

De tre typene plategrenser er Konvergent, Divergent og Transform. En oseanisk-oseanisk konvergent: Her går den tettere platen under den andre i en subduksjonssone. En kontinental-kontinental konvergent: Og i dette tilfellet dobles tykkelsen av skorpen ettersom konvergenten lager fjell
