
- Forfatter Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Sist endret 2025-01-22 17:06.
Molaritet er antall mol per volumenhet av løsning og molalitet er antall mol per masseenhet løsemiddel. Volum er temperaturavhengig der massen er konstant ved alle temperaturer. Så, molalitet forblir konstant, men molaritet endres med temperaturen. Derfor, molaritet foretrekkes fremfor molaritet.
I forhold til dette, hva er hovedfordelen med molalitet fremfor molaritet som konsentrasjonsenhet?
Begge brukes til å beregne antall mol oppløst stoff. Men ved å bruke molalitet term vi kan beregne antall mol oppløste stoffer i løsemiddel, så det gir fordel å vite antall mol oppløst stoff i løsemiddel mens du er i molaritet vi kan bare beregne antall mol oppløst stoff i løsning (per liter).
Dessuten, hvilken er bedre molaritet eller molalitet? Molalitet regnes bedre for å uttrykke konsentrasjonen sammenlignet med molaritet fordi det molaritet endringer med temperaturen på grunn av ekspansjon eller sammentrekning av væsken med temperaturen.
Videre, hvorfor brukes molalitet og ikke molaritet i uttrykket for frysepunktsdepresjon?
Kolligative egenskaper er fysiske egenskaper til løsninger, som koking punkt høyde og frysepunktdepresjon . Det er derfor vi bruker molalitet (mol oppløst stoff per kg løsemiddel) siden kg løsemiddel ikke endres med temperatur.
Hvorfor bruker vi Molality?
Konsentrasjoner uttrykt i molalitet brukes når man studerer egenskaper til løsninger knyttet til damptrykk og temperaturendringer. Molalitet brukes fordi verdien ikke endres med endringer i temperaturen. Volumet av en løsning, derimot, er litt avhengig av temperaturen.
Anbefalt:
Hva forteller molaritet oss om en løsning?

Molaritet (M) indikerer antall mol oppløst stoff per liter løsning (mol/liter) og er en av de vanligste enhetene som brukes til å måle konsentrasjonen av en løsning. Molaritet kan brukes til å beregne volumet av løsemiddel eller mengden oppløst stoff
Hva er surere en løsning med pH 2 eller en løsning med pH 6?

Forklaring: pH er et mål på surhet eller alkalitet til en løsning. konsentrasjonen høyere er surheten. En løsning med pH = 2 er derfor surere enn pH = 6 med en faktor på 10000
Hvilken enhet kan brukes til å uttrykke konsentrasjonen av en løsning?

Molaritet (M) angir antall mol oppløst stoff per liter løsning (mol/liter) og er en av de vanligste enhetene som brukes til å måle konsentrasjonen av en løsning. Molaritet kan brukes til å beregne volumet av løsemiddel eller mengden oppløst stoff
Hva er konsentrasjonen av hydroniumioner i en nøytral løsning?

Rent vann anses å være nøytralt og hydroniumionkonsentrasjonen er 1,0 x 10-7 mol/L som er lik hydroksydionkonsentrasjonen
Når bør man bruke korrelasjon og når bør man bruke enkel lineær regresjon?
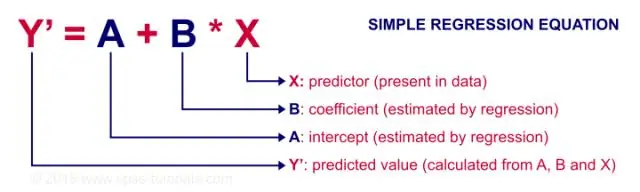
Regresjon brukes først og fremst til å bygge modeller/ligninger for å forutsi en nøkkelrespons, Y, fra et sett med prediktorvariabler (X). Korrelasjon brukes først og fremst til å raskt og konsist oppsummere retningen og styrken til relasjonene mellom et sett med 2 eller flere numeriske variabler
